


京都大学 川上浩司 2017年2月8日
医療ビッグデータ、リアルワールドデータという言葉は、2016年の一年間ですっかり臨床疫学の領域や産業界で定着した感がある。これまでは、医薬品等の評価としては、介入臨床研究としての市販後の臨床試験を実施して、狭義での製品の効果の理解のための研究が中心であった。しかし、IT技術や基盤の進歩によって、医療現場における各種の情報がデータベース化されることによって、わざわざ臨床試験を実施せずとも、より広く網羅的に医薬品などの効果や使用法や安全性を把握することができつつある。
医療におけるリアルワールドデータという言葉は、ここ数年でその定義が定まり、臨床試験に代替した薬剤の効果の測定のためのアウトカム研究、安全性評価、製品戦略、マーケティング費用対効果などの薬剤疫学研究に確実に応用できるという理解が進んでいる。市販後の薬剤のアウトカム研究については、もはや臨床試験の手法は採用せず、データベースの解析によって複数の薬剤の効果を一気に解析するという企業が増え始めている。そのほうが、時間も経費も格段に有利だからである。また、PMSについても、既存の特定使用成績調査の手法では、薬剤未使用群(比較群)がないため、実施しても得られる情報は極めて少ないことが問題であった。薬剤の安全性の評価も、アウトカム研究と同時にデータベースを解析することで、多くの情報を得られるということもわかってきた。
医療系データベースは、大きく分けて、医療現場で行われている情報をそのまま(改竄などなく)取得、整理してデータベースに格納される、リアルワールドデータ系のデータベースが4種類と、自発的に入力あるいは客観的に情報は取得するものの、精度管理には限界がある、リアルワールドデータではないデータベース2種類とに大別される。
リアルワールドデータ系の医療データベースとしては、診療報酬請求(レセプト)情報データベース、DPCデータベース、調剤薬局における調剤データベース、そして、電子カルテ(Electrical Medical Record ; EMR)由来の診療情報データベースに分類される。
図1に、これらのデータベースの特徴を示す。臨床研究におけるデザインや、企業の各種活動にとってどのデータベースが最適か、それぞれ得意不得意な点があるので、よく理解して活用する必要があろう。
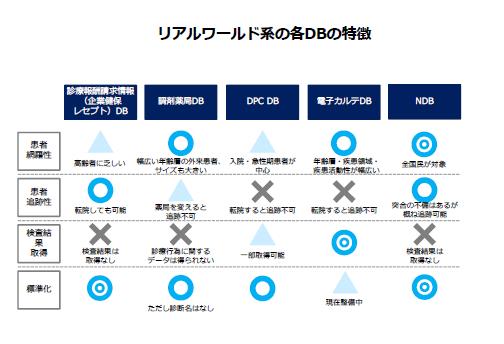
図1 リアルワールドデータの分類と特徴
レセプトデータベースは、厚生労働省の管理する国民健康保険(国保)を含むいわゆるナショナルデータベース(NDB)が有名であるが、まだ疫学研究への利用のためのデータベースの整理やデータセット提供の体制は整っていない。2015年から、京都大学病院と東京大学病院は、NDBの学術利用のためのNDBオンサイトセンターの整備を開始しており、今後、NDBの提供体制や研究への利用ができるようになると期待されている。現状では、製薬企業等の民間企業も利用可能なのは、400万人規模の企業健保組合由来のレセプトデータベースであり、株式会社日本医療データセンター(JMDC)が取り扱っている。患者の初診からの受動行動、すなわちpatient journeyを追跡できるのがレセプトデータベースの最大の強みであり、JMDCのデータベースは海外からの注目も高い。ただ、原資料が企業健保組合となるため、高齢者情報に乏しいという限界はある。また、費用請求に紐付いている項目が取得格納されているため、検査値等のアウトカムも存在しない。
DPCデータベースは、日本国内に存在する約1500の急性期病院において採用されている包括診療(DPC)制度を活用して、約250の病院と提携して、厚生労働省に提出されるDPC関連の情報を集約したデータベースを構築しているメディカル・データ・ビジョン株式会社(MDV)の運用する、のべ患者数1700万人規模のものが最大かつ汎用されている。本データベースには検査値等はまだ一部しか格納されていないが、DPC情報には、診断名や使用された薬剤のみならず、周術期の情報なども含まれており、急性期を中心とした医療現場での情報を理解することに優れている。
調剤薬局でのデータベースは、調剤薬局の系列店舗を経営する企業が、各店舗にて調剤された情報を統合して、患者への調剤の状況をまとめたものである。最も有名なものは、日本調剤系列の株式会社医薬総合研究所や、IMSジャパン、協和企画などが統合、運用しているデータベースである。リアルタイムに近い形で全国の調剤状況が提供されていることもあり、製薬企業ではおもに営業部門で使用されていることが多いようである。調剤データベースは、診断名、薬剤以外の治療行為、検査値等のアウトカムなどはわからないが、薬剤の関連情報としての併用薬、継続率、診療科の情報は提供される。ただし、継続率については、患者がかかりつけ薬局を変えていないかどうかはわからないため、その解釈には注意が必要である。
私の主宰する京都大学大学院研究科・薬剤疫学教室では、これまでに、上述のような各種のデータベースを使用して、数多くの臨床疫学研究や薬剤疫学研究を実施し、国際誌に英文論文を発表している。しかし、医療データベース研究をより深堀するためには、各種の検査値や、画像診断や病理の結果、また、場合によっては看護記録の記載も必要になるため、かねてより、我々はこれらを包含した電子カルテ(EMR)由来の診療情報データベースを待望してきた。昨今、厚生労働省やPMDAによって、複数の国立大学病院や徳洲会グループ病院、NTT病院の電子カルテ由来の情報を統合したMID-NETが提唱されて、市販後安全対策にはセンチネルプロジェクトが稼働している。現時点での患者総数は300万人に達すると聞いている。しかし、これらは、まだ当該医療機関のみしかアクセスすることができず、製薬企業への運用を含めた門戸も実質的には開かれていない。さらに、現時点では、一般化可能性には必ずしもそぐわないデータ源となっており、各種の臨床疫学研究に簡便、効率的であるわけではない。
そこで、学校健診、母子保健、介護施設における高齢者健康情報などのデータベースを構築している一般社団法人健康・医療・教育情報評価推進機構(HCEI)は、2015年夏より、全国の多くの医療機関と連携をして電子カルテ由来の各種情報も収集している。膨大な診療情報は、リアルワールドデータ株式会社(RWD)の技術支援によってデータベース構築を行い、研究機関や製薬企業等に対するデータセットの提供(二次利用)を開始している。現時点では、117医療機関と契約し、契約ベースでは1300万人規模の患者数となっている。2018年度には、2000万人規模、200を越える連携機関数を目標としている。医療機関における電子カルテ由来の診療情報データベースは、血液、呼吸機能、肝機能、腎機能、各種バイオマーカーなどの検査値を網羅的に取得し格納しているため、とくに、薬剤や治療の効果を測定するためのアウトカム研究、副作用の解析のためのPMS、医療現場の実態を把握するための記述疫学研究やマーケティング、また臨床情報と別途取得したQOL/PRO情報とを用いて実施する医療技術評価(HTA)のための費用対効果算定には、きわめて強力なツールとなる。
さて、一方、リアルワールドデータ系ではないデータベースには、古典的な疾患登録(レジストリ)と、個人の生活習慣、行動や嗜好を取得するElectrical Health Record (EHR)の2種類が存在する。
疾患登録は、一定の疾患などに関して、原則として患者単位で診断名、薬剤を含む治療行為、転帰などを記載していった個票を統合したものである。昨今では、疾患登録も電子化が進み、とくに有名なものは、日本外科学会が中心に運用、維持しているナショナルクリニカルデータベース(NCD)である。外科医が、自身の診療した患者の各種情報を登録システムにて記入し、中央一括でデータベース化するという方式をとっている。参加している病院の外科医が疫学研究に活用することを目的としていたが、昨今では、PMDAでの医療機器の安全対策等の解析や、製薬企業への門戸も開放することを計画しているとのことである。その他にも、東京女子医科大学膠原病リウマチ痛風センターが主体となって構築している、関節リウマチの疾患登録(IORRAコホート)、全国の新生児科を中心に未熟児の登録がなされているNeonatal Research Network (NRN)などは、レジストリ系のデータベースとなる。これらのデータベースの最大の強みは、リアルワールドデータ系のデータベースには格納されない、医師等が促されて記入するような臨床所見や、各種スコア、アウトカムをも登録できることにある。
EHRは、個人のアンケート結果や各種の健康以外の情報ソースから取得するもので、個人の健康に影響を与えうる、社会的、生活習慣的な要因を指す。すなわち、学歴、人種、年収、ストレス、喫煙、飲酒、コミュニティでの活動、夫婦家庭関係などである。米国では、保険会社がこのような情報を悉皆で取得、統合して、病気の発症リスクなど解析するような動きが進んでいる。薬剤そのものよりも、このような社会的要因が健康や医療の効果に与える影響が強い可能性も大いにあるため、今後の動向が注目されている。なお、日本では、このような詳細のアンケートは、個人情報に過剰に敏感な国民性から、なかなか実施することができない。そこで、我々は、商品の購入時に提示する各種のポイントカードによって消費者のログを収集し、個人の行動や社会的要因を推測するという研究も準備している。このようなログ情報と、薬剤の使用、診療情報での検査値などを、個人の同意に基づいて併せて解析すると、日本ならではの疫学研究が実施できるのではないかと私は考えている。
上述の2種類は、それぞれきわめて重要な項目を含んだデータベースであるが、医療現場の各種情報がそのまま転記、集約されているのではなく、データベース構築のために、別途自記記入が必要となっているため、情報の信頼性などには注意を要する。ただし、ポイントカードによる行動ログは、実社会を反映し得ることはいうまでもない。
わが国においては、2005年の「医薬品の製造販売後の調査及び試験の実施の基準に関する省令」(通称GPSP省令)の施行に基づいて、製造販売承認後に数百~数千症例の当該医薬品の投与を受けた患者からの副作用の発現についての情報を収集し、取り纏めて当局に提出することが義務付けられている。しかしながら、その方法としては、医師に謝礼を支払って症例情報に記入して頂いた調査票に基づいており、医薬品医療機器レギュラトリーサイエンス財団からの2014年9月2日の提言にもあるように、とても国際社会で存在感を示している現在日本の医薬政策とは思えない極めて前時代的な手法となっている。さらに、その調査は医薬品を投与された患者の選択妥当性に乏しくコホートが曖昧であり、さらに同じ疾患でも当該医薬品を投与されていない患者との比較もなく、ケースコントロールの体もなしていない。すなわち、臨床研究としても学術的意義や根拠に乏しいと言わざるを得ない。また、現行のPMSにおいては、前向き研究の体をなすのにも関わらず、インフォームドコンセントを患者から取得しておらず、国際レベルの臨床研究の実施を目指す日本の姿勢とも合致しないものとなっている。実際に、欧州では日本の現行PMSの結果は科学的であるとは認められず、医薬品の市販後データとして使用するための基準であるPost-Authorization Safety Study (PASS)からは外されている。すなわち、外資系製薬企業は、日本のこれまでのPMSデータは海外で用いることができず、無駄なコスト増につながっている。
このような状況の中、厚生労働省や医薬品医療機器総合機構(PMDA)は、2015年7月にプレスリリースを行い、市販後安全対策に役立てるため、2018年までに診療情報データベース等にもとづいた電子的なPMS提出のためのガイドライン作成をはじめるという趣旨の発表をした。その後、2016年からは、PMDAの関連部署、製薬企業の業界団体である日本製薬工業協会のメンバー、民間の医療系データベースの業界団体である医療データベース協会の間で会合が開かれ、製薬企業がどのように医療データベースを活用してPMSを実施し、当局に提出するかという想定を踏まえたデータの品質についての議論が行われている。2017年には、GPSP省令を改訂することで、医療データベースを用いたPMSの受付を開始する見込みである。企業から当局に提出する形式については、CDISCは求めない方向性であり、従来型のPMSとデータベースに基づく提出は、各企業の考え方や体制もあるので、しばらくは併存する見込みと聞いている。しかしながら、いずれ従来の方式からデータベース主導に切り替えられていくであろうと考えられる。
以上のように、今後のPMSに対応してゆく上で、従来型PMSから新たにデータ主導に切り替えていくことが製薬企業にとって重要であり、安全対策とアウトカム研究を同時に内包したより幅広い情報の活用が可能となっていくことは間違いない。既存の特定使用成績調査の手法では、薬剤未使用群(比較群)がないため、実施しても得られる情報は極めて少ないことが問題であったが、医療データベース、とくに診療情報由来の検査値も内包したデータベースを活用することで、薬剤の承認後の副作用の発生状況、他剤使用時との比較、副作用発現に寄与する背景因子の解析などが可能となる。
電子カルテを用いた各種の解析のありかたについて、私は、せっかくデータベースを構築するのであれば、疾患登録(レジストリ)を電子カルテでの入力に連動できないかと考えている。そこで、試行的に、ある病院で疾患名や薬剤名の入力に紐付いて、自動的に疾患登録画面が立ち上がり、電子カルテでの記入から取得できる項目はすべて転記され、それ以外の項目のみをできる限り省力にて入力できるシステムを作成したところ、極めて良好に稼働できることがわかった。これにより、診療情報データベースにおいては、疾患登録や、特定の薬剤などを使用するときの注意喚起、PMSにおける薬剤と有害事象との因果関係の記載なども連動できることになり、さらなる発展が期待できることになる。
市販後の医薬品のアウトカム研究として行われた介入臨床試験において、製薬企業から処方権のある臨床医の在籍する大学等アカデミアへの費用提供を寄付行為によって行ってきたという利益相反への懸念、不適切なデータ管理によるデータ品質やその解析結果への信頼性の欠如といった問題は、医薬品の使用にかかるエビデンスを創出するためのアウトカム研究そのものの根幹をゆるがす社会的問題となった。アウトカム研究の振興は、医薬品の価値を見出し、その適正使用を推進するために重要であることには論を待たない。一方で、臨床研究基本法(仮)も国会で議論される見込みであり、GCP準拠を求められ、今後より一層の厳格化が求められようとしている臨床試験としてアウトカム研究を実施してゆくには、その学術価値、経済性、倫理性のいずれも見直しが必要となろう。そのような背景のもと、アウトカム研究も、その研究デザインを介入研究から観察研究デザインへと方向転換しつつある。製薬企業や医療機器企業にとっては、健保組合由来のレセプトデータや、医療機関におけるDPCデータ、電子診療情報から匿名化したデータベースに由来した、匿名加工情報として提供されるデータセットを利用するアウトカム研究や医薬品等の評価の実施は、利益相反などの懸念を心配することなく、医薬品間の効果の比較などをすることが可能となる。
すでに利用が開始されている健保組合由来のレセプトデータや医療機関におけるDPCデータでの研究に加えて、電子カルテ由来の診療情報データベースの場合は、薬剤の効果について、検査値や臨床所見をアウトカムとして評価するというこれまでにない評価の手法を可能とする。そのため、2016年10月に大阪で開催された国際医薬品規制調和会議(ICH)においては、ICH-E8を改正して、従来は介入臨床試験の結果のみを根拠として、薬事承認がなされ、薬剤の適応すなわち添付文書が定められていたが、今後は、データベース研究による観察研究の結果によって、承認の上、薬剤の適応を定めることの議論が開始された。新規の薬剤を観察研究の結果によって承認することには様々な障壁があるが、既に販売されている薬剤について、適応の追加や拡大がデータベース研究によって認められるようになる可能性は極めて高いと考えられる。製薬企業にとっては、疫学研究を主軸におくことによって、開発にかかる費用も時間も大幅に短縮することが期待できる。ICHでは、データベースの品質や活用法も議論される見込みであり、今後の動向が大いに注目される。
欧米のみならず、わが国でも、医療提供体制の根幹をなす国民皆保険制度において、診療報酬の議論をおこなっている中央社会保険医療協議会(中医協)は費用対効果専門部会を設置し、日本でもHTAを2016年から試行的導入され、今後の本格導入に向けた整備が始まっている。薬剤のHTAを実施するためには、診療情報、臨床試験、レセプト情報などから得られる臨床情報と、Quality of Life (QOL) / Patient-Reported Outcomes (PRO)といわれる患者の主観的な申し出情報、費用情報が必要となる。国民皆保険下における費用情報は一定と考えられるため、市販後の医薬品について、質調整生存年(Quality-adjusted life years; QALY)を計算する場合には、とくに診療情報とQOL/PRO情報が重要となる。
HCEI-RWDの取組の一つとして、レジストリに関しては、病院の現場で、電子カルテに連動して、診療記録や看護記録、検査値データからコンピュータがレジストリの様式に必要情報を自動転記しておき、医師の診察時や退院時サマリの作成時に、記載漏れのある必要項目のみを記入すれば自動的にレジストリが完成していくという支援ツールも開発されている。この仕組みを応用して、図2のように、薬剤の臨床効果を把握することができる診療情報データ(RWD)と、別途、QOL/PRO調査を受託いただける施設で取得した患者のQOL/PRO情報を突き合わせて解析することができれば、どのような検査値のときにどのようなQOL/PROなのかという、これまでにない精緻な薬剤の評価を行うことができる可能性がある。このような仕組みの構築が進めば、製薬企業にとっては、薬価改定時など、製品ライフサイクルマネジメントへの戦略的活用に大いなる福音をもたらすようになろう。
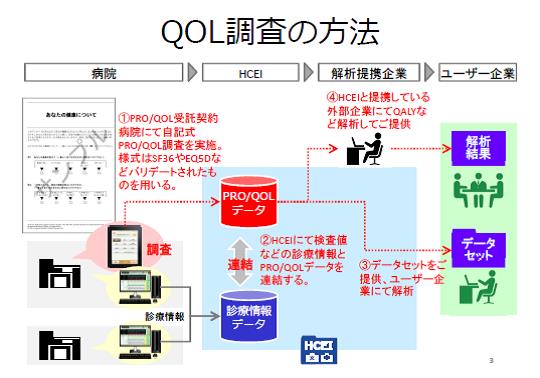
図2 自動レジストリ入力システムを応用したQOL/PROデータの収集
米国などの諸外国では、アカデミアや産業界によるリアルワールドデータの活用はますます活発となっている。以下のように、医療や薬剤の安全性評価をリアルタイムに行う取組や、自然言語処理の取組などが例として挙げられる。
リアルタイムな薬剤の安全性評価については、大規模な電子カルテ由来診療情報のデータベースから、ある薬剤の使用状況についてのデータセットをリアルタイムに閲覧できるような仕組みを構築して、副作用や疑わしいイベントの発現をシグナルとして確認するというものである。これを試行的に開始している製薬企業もあり、成果や更なる応用が期待されるところである。もちろん、市販後の安全対策のみならず、薬剤本来のアウトカムや予想外の有効性も同時に追跡できるので、薬剤の価値を訴求する場合はきわめて有用なツールとなろう。ただ、まだどこまで技術的、費用的に実施できるかは未知数のところも多い。私達もこのような取組には関心をもっており、協業できる企業等があればと考えているところである。
自然言語処理の取組は、電子カルテ由来の診療情報のうち、自由記載部分から、どのような訴えのある患者が、その後どのような転帰となるのかという解析のために、キーワードや検査値のシグナルと臨床アウトカムをもちいた薬剤疫学研究を行い、薬剤の効果の予測や副作用発現を予測するモデルをつくるというものである。薬剤の評価のみならず、たとえば、精神科領域においては、患者からどのような言葉を繰り返される場合にどのような症状が出現するかなどを予測できるのではないか、ということも期待される。
日本ではまだこれらの取組はないようであるが、今後、ますます重要となるリアルワールドデータの利活用の可能性は無限大であり、より経験を深めることが求められよう。
以上